A differenza delle normative europee, che devono essere recepite dallo stato membro, il Regolamento è immediatamente operativo anche se è prevista una gradualità di attuazione (art.121) con rivalutazione dei risultati ottenuti prevista per il 27 maggio 2027.
Si tratta di un Regolamento molto complesso nato per tutto il settore sanitario compreso quello odontoiatrico. Il legislatore è intervenuto andando a superare e sostituire una pregressa norma europea in vigore dal 1997 (Direttiva CEE 93/42) a seguito del clamore mediatico suscitato da alcuni incidenti e reazioni avverse a determinati tipi di protesi per ricostruzione mammaria e a valvole cardiache difettose. L’evidenza della mancanza di informazione al paziente sulla tipologia e provenienza del DM utilizzato e l’assenza di un sistema che permettesse alle autorità sanitarie l’immediata individuazione di tutti i pazienti che avevano ricevuto un DM rivelatosi difettoso ha generato l’esigenza di tipizzare ogni DM con un codice unico di identificazione inequivocabile (denominato UDI) e di istituire una banca dati europea
(EUDAMED) in modo da tracciare, almeno per i DM impiantabili, tutta la filiera, dal produttore fino all’utilizzatore finale, individuando esattamente il paziente su cui è stato impiantato su tutto il territorio europeo.
Il Dispositivo Medic o (Medical Device MD), per definizione (art.2), è qualunque strumento, apparecchio, software, impianto… destinato dal fabbricante ad essere impiegato sull’uomo … per una delle seguenti destinazioni d’uso specifiche: diagnosi, terapia, prevenzione, monitoraggio, prognosi …. trattamento ed
attenuazione di malattie … compensazione di una lesione o di una disabilità … studio, sostituzione o modifica della anatomia o di un processo fisiologico … interventi sul concepimento. La definizione di DM impiantabile (art.2, p.5) invece recita “qualsiasi DM, compresi quelli parzialmente o totalmente assorbiti, destinati ad essere impiantati totalmente nel corpo umano mediante intervento clinico e a rimanere in tale sede dopo l’intervento.
I DM sono classificati in base ai criteri dell’Allegato 8 in tre classi: 1, 2, 3. La classe 2 è ulteriormente distinta in due sottoclassi 2a e 2b. In particolare:
- regola 8: tutti i dispositivi impiantabili ed i dispositivi invasivi a lungo termine di tipo chirurgico rientrano nella classe 2b… tranne quando … abbiano un effetto biologico o siano interamente o in gran parte assorbiti nel qual caso rientrano nella classe 3.
Sono comunque esclusi dalla definizione di DM impiantabili: materiali da sutura, materiale da otturazione dentale, apparecchi ortodontici, corone dentali, placche e protesi oltre che graffette, cunei, fili, chiodi, clip e connettori (art.18, p.3).
Apparecchi ortodontici, corone dentali, placche e protesi rientrano invece nei DM su misura (art.2, p.3) per i quali è prevista specifica prescrizione da parte del professionista abilitato e sono destinati ad un unico specifico paziente. Nello stesso punto il regolamento cita anche i DM fabbricati in serie che non richiedono prescrizione e necessitano di manovre di adattamento da parte del professionista abilitato ed altri, sempre in serie, che necessitano di prescrizione.
Questa suddivisione, non scevra di ambiguità, ha creato svariati dubbi interpretativi che ha portato il MDCG (Medical Device Coordination Group) organo di armonizzazione europea ad ulteriormente definire:
1. DM su misura (custom made): richiede prescrizione ed è paziente specifico. Le protesi fabbricate dall’odontotecnico dotate di dichiarazione di conformità rientrano in questa categoria.
2. DM adattabile (adaptable DM): dispositivo medico prodotto in serie, adattato e assemblato nel luogo di cura del professionista sulla base delle istruzioni del fabbricante per un determinato paziente. Il professionista che adatta il DM non è il fabbricante (es. corone provvisorie Yon o Protemp che richiedono
adattamento e ribasatura).
3. DM personalizzato (patient-matched): DM realizzati dal professionista abilitato nel luogo di cura (chair-side) a partire da un DM in serie (certificato dal fabbricante) sulla base di anatomie specifiche rilevate sul paziente (quali quelle ottenute con scansioni 3D) e realizzati con tecniche CAD-CAM senza necessità
di prescrizione.
Recentemente alcune aziende produttrici di allineatori ortodontici (DM su misura che prevedono una prescrizione sulla base di una diagnosi, il rilevamento di informazioni anatomiche specifiche del paziente ed un controllo del risultato terapeutico nel tempo da parte del professionista abilitato) hanno chiesto al Ministero della Salute di declassare gli allineatori trasparenti a DM in serie.
ANDI ha già evidenziato la “anomalia” di tale richiesta e sta seguendo l’iter di essa.
Quindi applicando queste regole al settore odontoiatrico:
- i materiali per otturazione dentale sono in Classe 2;
- gli impianti osteointegrati e le membrane non riassorbibili sono in Classe 2b;
- i materiali sostitutivi/osteoconduttivi dell’osso e le membrane riassorbibili sono in Classe 3.

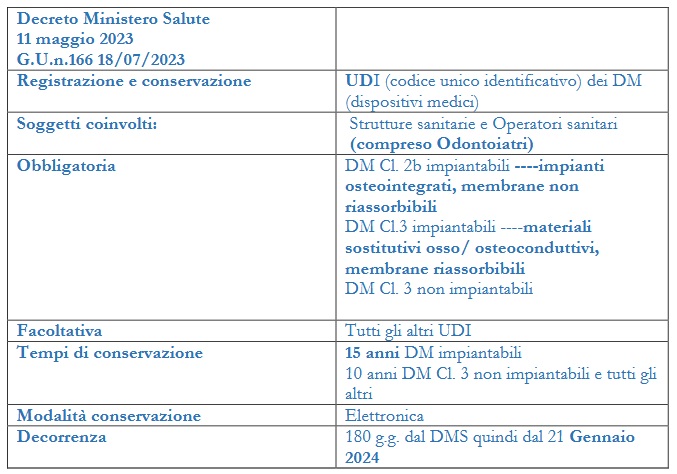
Ai fini della tracciabilità dei DM che, come esposto prima, rappresenta un obiettivo cardine dell’MDR 745/17, l’art. 27 paragrafo 8 indica che gli stati membri incoraggiano gli operatori sanitari e possono obbligarli a registrare e conservare, preferibilmente per via elettronica, gli UDI dei DM che hanno ricevuto.
Lo stato italiano con il D. Lgs n.137/2022 art.15 ha stabilito per questo l’obbligo e il Decreto del Ministero della Salute del 11 maggio 2023 (GU n.166 del 18/07/23) ne sancisce le modalità.
In particolare:
Art.1: stabilisce l’obbligo di registrazione e conservazione dell’UDI da parte delle istituzioni sanitarie e degli operatori sanitari (l’odontoiatra è un operatore sanitario) qualora non esercitino la propria attività professionale presso una struttura sanitaria.
Art.2: l’UDI è suddiviso in UDI-DI che identifica il modello del dispositivo e UDI-PI che individua invece il produttore.
Art.3: la registrazione dell’UDI riguarda obbligatoriamente i DM di Classe 3 impiantabili e non impiantabili e quelli di Classe 2b impiantabili (p.1 e 2). Nella tabella sono riportati i DM di interesse odontoiatrico che rientrano in questo obbligo. Su base volontaria (allo stato attuale non è un obbligo) possono essere registrati gli UDI dei DM che sono stati ricevuti al di fuori di quelli già specificati (p.3).
Art.4: La registrazione e la conservazione degli UDI deve essere realizzata in modalità elettronica. Gli operatori economici sono tenuti a fornire queste informazioni
in formato elettronico.
Art.5: le informazioni registrate devono essere conservate per un periodo di 15 anni, dal momento della registrazione per i DM impiantabili di classe 3 e 2b; per quelli in classe 3 non impiantabili 10 anni.
Art.7: questi obblighi decorrono dopo 180 giorni dall’entrata in vigore del decreto (21 gennaio 2024).
ANDI si è già attivata in modo da fornire ai propri associati un software per tutti i Soci che decideranno di utilizzarlo in tempo utile per adempiere correttamente a questo obbligo di legge. Tramite questo supporto informatico sarà possibile la registrazione dell’UDI nel momento dell’acquisto del DM (anche attraverso la lettura del QR Code) e l’abbinamento successivo con il paziente sui cui è stato impiantato.
Si ricorda che dall’entrata in vigore dell’MDR 745/17 è fatto obbligo di consegnare al paziente in versione cartacea (UDI su etichetta adesiva) i dati di cui sopra relativi ai DM impiantati tramite il “Passaporto implantare”: pertanto tutti gli Odontoiatri sono già obbligati al rispetto di tale adempimento.

L’articolo Nuovo aggiornamento sul recepimento del Regolamento Europeo Dispositivi Medici (MDR 745/2017) proviene da ANDI.